新药研发真的需要数十亿美元吗?
- Categories:Investment Research
- Author:
- Origin:
- Time of issue:2020-09-07
- Views:0
新药研发真的需要数十亿美元吗?
(Summary description)
- Categories:Investment Research
- Author:
- Origin:
- Time of issue:2020-09-07
- Views:0
新药研发真的需要数十亿美元吗?
去年《我不是药神》让大家对药品研发的耗时费力都有了一些了解,业界普遍流传着一句话:“一个药品从研发到上市需要花费数十亿美金”。

如果这是真的,那创新药公司也太有钱了!
没错,创新药公司就是很有钱。
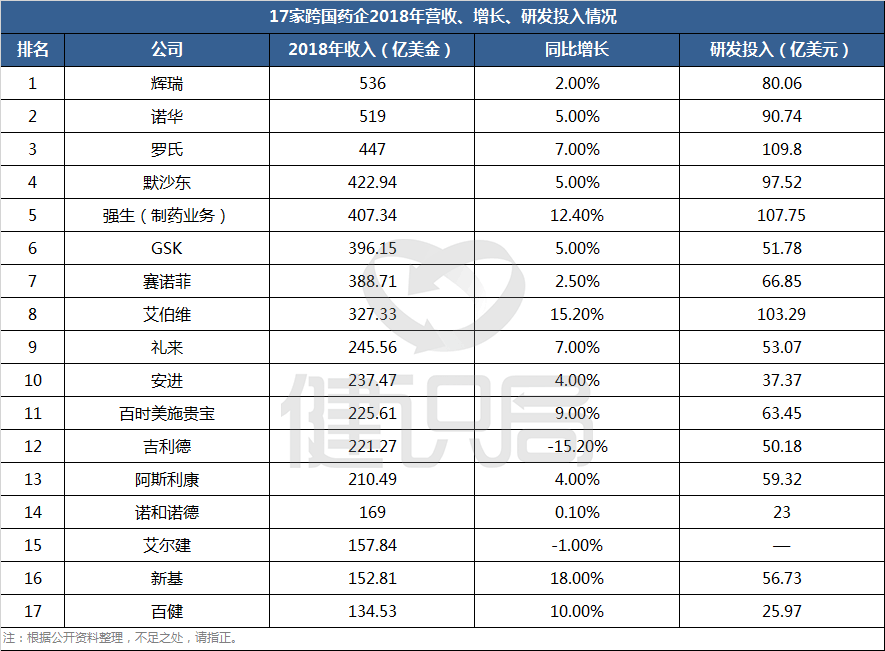
2015年制药行业合计研发投入高达1098亿美元,FDA也丧心病狂的批了45个小分子及抗体类新药,近年来最多的一年,平均24.4亿美元一个。当然,这么算不太严谨。创新药研发确实是一个耗时费力还需要极高的资源和财力投入的事情,业内说的几十亿美元一个新药的说法,是有条件的。不是所有的新药都要这么多钱,花了这么多钱的新药目的是为了成为重磅炸弹(年销售收入超过十亿美金的药物)。
下面我们就从创新药研发的各个流程切入,以一个first in class(FIC),即全新治疗领域的全新药品为例,计算一下一个要花多少钱做出一个项目?
Step 1靶点确认(0.3亿)
靶点是大部分药物研发的基础之基础(肠道菌群药物、中药等除外)。有些靶点可能是科学家在大学里面发现的,有些是药厂的研发团队发现的,还有些是先发现化合物再找靶点的。靶点发现的费用不固定,很大程度上依靠运气,但是靶点的质量直接决定了项目成败。
Step 2 Hit identification(0.2亿)
靶点确认之后需要筛选化合物。最经典的办法是用化合物库结合alpha screening,化合物库可以是天然产物库,独有库或者商业化小分子化合物库,alpha screening也可以用其他的HTS手段代替。这个阶段可能需要筛选数十万个化合物。而且,HTS方法的成本也要考虑进去。以20万个筛选为假设,假设100美元一可以购买一个化合物并完成一次筛选,只要区区2000万。
Step 3 Hit to lead(0.1亿)
在上一步拿到的有潜在活性的化合物是所谓的hit,杂乱无章而且可能有毒,活性一般也不够。这个时候需要进行结构方面的扩展。如果一系列结构类似的化合物在一个靶点上展现出了活性,我们可以将最开始筛选出来的化合物称为lead,这个系列的化合物称为lead series。可以假设一个group花了一年时间完成这项工作,一个group一年花1000万美金,则需要1000万即可拿到结果。
Step 5 Lead optimization(0.2亿)
现在有多于一个的lead series,合理的策略是开2-3个组,每个组一个candidate同时推进,在1年内将活性提高到sub-nM的级别,并进行初步的PK与PD研究,保证东西不要太差。假设3个组干一年,花掉2000万,拿到3个候选化合物(preclinical candidate)。
Step 6 Preclinical & CMC(0.1亿)
接下来就需要通过动物研究证实你的分子的安全性了。3个组的分子都要做, FDA对于全新分子实体很在意,毒理要做充分,往往会提交很多毒理研究。符合FDA申报需求的研究大概1000万可以做到,包括活性确证,PK,毒理全套研究。CMC在这个阶段的花费并不高(这个阶段的药剂学研究往往不会很精细,倒是晶型要下点功夫)。
Step 7 Filing Patent etc(0.1亿)
这么好的东西拿到手,被人申请了专利还了得?所以专利工作同步推上去。另外,做完了要申报的。加起来1000万美元,全球专利+FDA临床申报+准备打官司。
Step 8 IND
在FDA做IND申请几乎是免费的,主要是时间成本。
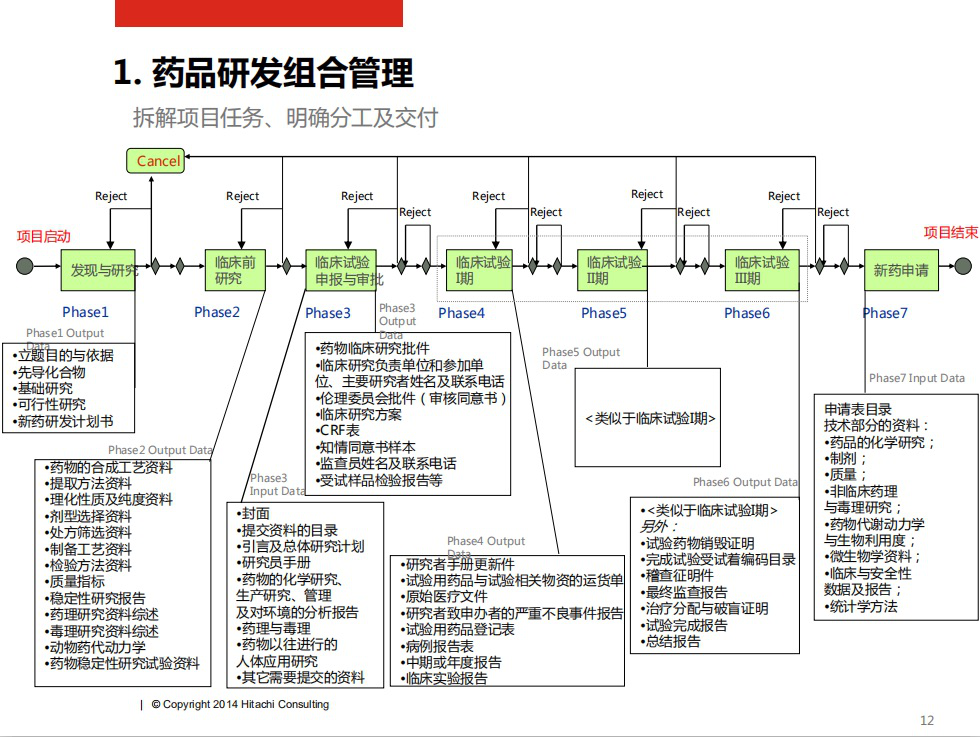
药物研发的大致流程
Step 9临床I期(0.05亿)
花了差不多1亿美元,终于上了临床了。I期是药动学研究,在健康人身上进行的,验证药物的安全性。假设在美国欧洲日本各进行一次,每个实验招募100人,每人10000美元的研究费用,再加上基因组对药物代谢的影响,满500万美元。
Step 10 临床II期(0.8亿)
之前的研究是在健康人身上的,现在要做病人身上的药动学研究了,确认药物在患者身上的安全性和有效性,以及提示III期的终点设计,一般需要100-300人。多数first in class不止需要一个II期研究,有时还会中途更改设计和终点。一例志愿者至少会花费10万美元,还需要其他调整费用。10万美元的计算依据是,参与临床研究的受试者可以接受免费治疗,发达国家的医疗成本又很高,如果是癌症志愿者轻松突破10万元。
Step 11 临床III期(3亿)
III期一般需要300-3000名志愿者,根据适应症和已上市药物略有不同,上万人参加,耗时多年的三期实验历史上也出现过。还是遵从上一步的假设,10万美元1例,做上3000例,花掉3个亿。
Step 12 FDA申报(0.1亿)
FDA审批要排队的,如果你出钱,也能够买到优先审评券,要上亿美元。这个阶段假设不买审评券,正常走下来的话,要动用公司最好的人力,这个不好算,暂以1000万为准。
Step 13 FDA批准后,终于可以上市了
上市后没有完,要想卖得好还需要继续投入。进行上市后研究吧(IV期)。好处是这个时候药物是收钱的,坏处是要求的例数多。越是受众广泛卖得好的,越要多研究。这个也没准,整个生命周期至少要花1亿美金。也别觉得这是冤枉钱,没有大量的研究支持,没有医生是敢用这个药的。
总得算下来,一个FIC从临床前研发到上市,保守来看需要5亿美金左右,当然这个数字只是预估。实际上如果针对罕见病、肿瘤等适应症,由于患者人数较少,实验志愿者人数和时间可以缩短,花费小,这也是为什么小型的创新药公司喜欢在这类领域寻找突破的原因。但对于如心血管病、糖尿病等疾病,患者人数众多,并且已有上市药物,实验时入组志愿者人数多,还需要与已上市的药物做长期的对照实验,花费较大。
但其实对于药企来说,最大的成本在于研发过程中每一阶段都会倒下无数的candidate,花了很多年终于实现全合成的某个药物分子被发现并没有什么疗效或者副作用简直是毒药的情况比比皆是,甚至还有一家上市的药物因为严重的不良反应被迫召回不在销售(如Thalidomide)。
更让人心痛的是,每一种上市的新药,背后都是尸横遍野,不仅是失败的候选药物,还有不幸的细菌细胞小白鼠们,甚至是志愿者都献出了生命。

Scan the QR code to read on your phone
Online Search
凯联资本 专业成就信任
CONTACT
Add:39th Floor,T3,Wangjing SOHO,Chaoyang Dustrict,Beijing,China 100102
Email:kefu@capitallink.cn

